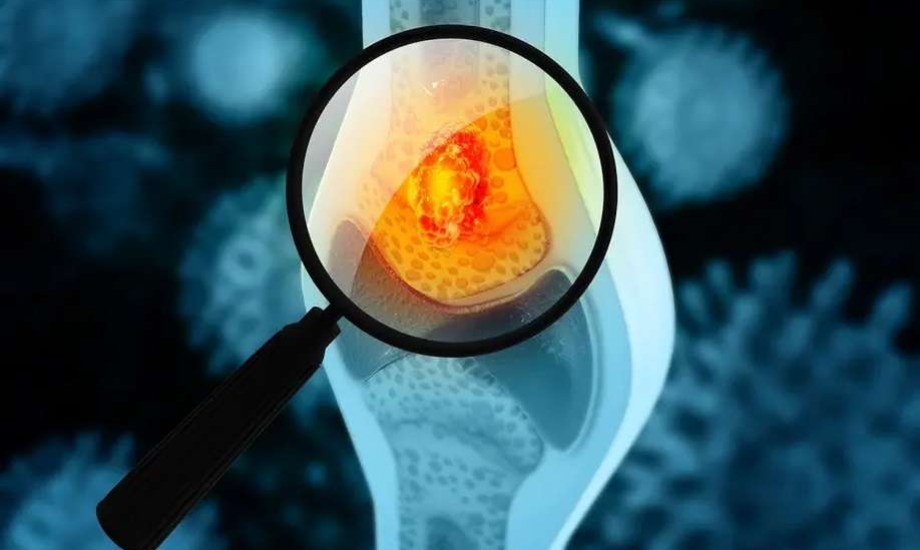
دواء جديد لعلاج مضاعفات العظام لدى مرضى الأورام
أعلنت شركتا Shanghai Henlius Biotech وOrganon عن موافقة إدارة الغذاء والدواء الأمريكية (FDA) على عقار Bilprevda، وهو دواء حيوي مماثل لعقار Xgeva، لعلاج مضاعفات العظام المرتبطة بأنواع مختلفة من الأورام الحميدة وغير الحميدة.
خطوة جديدة لتوسيع خيارات العلاج
يُعد اعتماد Bilprevda خطوة مهمة في توسيع إمكانية الحصول على العلاجات الحيوية الفعالة بتكلفة أقل، حيث أوضح جون مارتن، المدير التجاري بشركة Organon في الولايات المتحدة، أن هذه الموافقة تعزز التزام الشركة بتوفير علاجات عالية الجودة للعناية بصحة العظام خاصة لدى الفئات الأكثر عرضة مثل كبار السن والنساء.
 دواء Bilprevda لعلاج مضاعفات الأورام والعظام
دواء Bilprevda لعلاج مضاعفات الأورام والعظام
الاستخدامات الطبية للعقار
يعمل Bilprevda كمثبط لبروتين RANK ligand (RANKL) المسؤول عن تدمير أنسجة العظام ويُستخدم في الحالات التالية:
الوقاية من المضاعفات العظمية لدى المرضى المصابين بالأورام التي تنتقل إلى العظام أو أورام نخاع العظم.
علاج أورام الخلايا العملاقة في العظام التي لا يمكن استئصالها جراحياً أو التي قد يؤدي استئصالها إلى مضاعفات خطيرة.
علاج فرط الكالسيوم في الدم الناتج عن الأورام عندما تفشل العلاجات الأخرى.
تحذيرات وإرشادات طبية
نبهت الشركة إلى ضرورة فحص مستوى الكالسيوم في الدم قبل بدء العلاج إذ يمكن أن يسبب العقار انخفاضاً حاداً في الكالسيوم أو حالات نادرة من الحساسية المفرطة، كما أوصت بإجراء فحص للأسنان قبل بدء العلاج لتجنب مضاعفات مثل نخر عظم الفك (ONJ) وتجنب أي إجراءات جراحية فموية أثناء فترة العلاج.
كذلك حذرت من احتمال حدوث كسور غير تقليدية في عظمة الفخذ وطالبت المرضى بإبلاغ الطبيب فوراً عند الشعور بألم غير معتاد في الفخذ أو الورك، كما نصحت النساء القادرات على الإنجاب باستخدام وسائل منع الحمل خلال فترة العلاج ولمدة خمسة أشهر بعد آخر جرعة بسبب احتمال إضرار الدواء بالجنين.
 تحذيرات وإرشادات طبية
تحذيرات وإرشادات طبية
فعالية مماثلة للدواء الأصلي
اعتمدت موافقة إدارة الغذاء والدواء على حزمة بيانات شاملة تضمنت دراسات مقارنة بين Bilprevda والدواء المرجعي Xgeva، وأظهرت النتائج تطابقاً في الفاعلية والأمان والنقاء الحيوي.
وأكد الدكتور جايسون زو، الرئيس التنفيذي لشركة Henlius، أن "هذه الموافقة تؤكد جودة التصنيع والبحث العلمي في تطوير الأدوية المماثلة وتفتح الباب أمام وصول عدد أكبر من المرضى إلى علاجات بيولوجية موثوقة".