الأمل يقترب.. دواء جديد لأورام البنكرياس يحصل على تصنيف المسار السريع من الـFDA
أعلنت شركة Verastem Oncology، المتخصصة في تطوير العلاجات الموجهة للأورام المعتمدة على مسار RAS/MAPK، أن إدارة الغذاء والدواء الأميركية (FDA) منحت عقارها التجريبي VS‑7375 تصنيف Fast Track Designation، ما يمهّد الطريق لتسريع عمليات تطويره ومراجعته.
هدف علاجي واعد
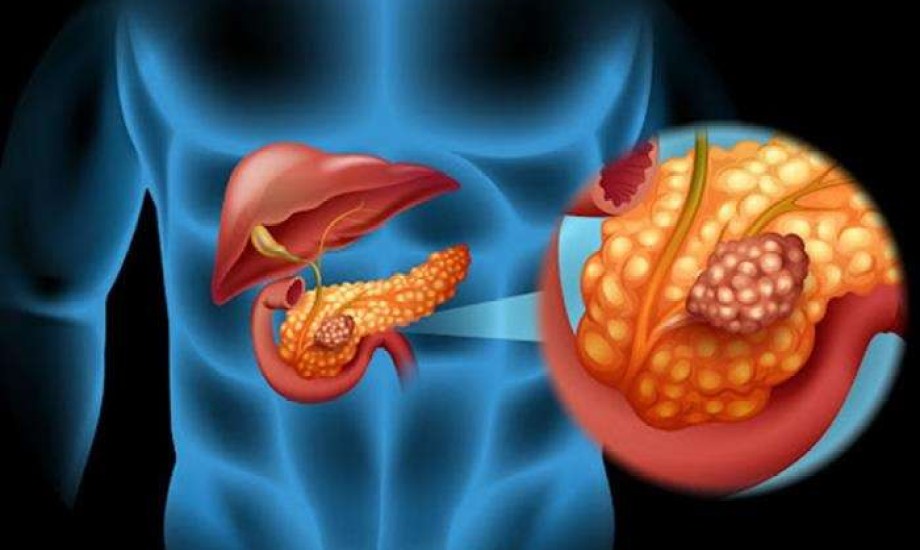
يستهدف العقار الجديد فئة من الأورام في البنكرياس التي تحمل طفرة KRAS G12D وهي طفرة معروفة بأنها من بين الأكثر شيوعاً في هذا النوع من الأورام، ويُعد VS‑7375 مثبطاً فموياً تم تطويره لتثبيط نشاط الطفرة في وضعي التشغيل والإطفاء (ON/OFF)، ويُجرى استخدامه حالياً في دراسة سريرية كخط علاج أول أو بعد فشل خط علاجي واحد على الأقل من العلاجات التقليدية.
 هدف علاجي واعد
هدف علاجي واعد
آمال جديدة مدعومة بنتائج أولية
صرّح دانيال باترسون، الرئيس التنفيذي لشركة Verastem Oncology، أن الحصول على هذا التصنيف يُعد بمثابة خطوة مهمة للعقار الواعد، مضيفاً: "نحن نسرّع العمل على تطوير VS‑7375 بالتزامن مع تسجيل المرضى في تجربة سريرية من المرحلة 1/2a تُجرى حالياً داخل الولايات المتحدة".
وأشار إلى أن النتائج الأولية التي قدمها شريك التطوير الصيني GenFleet Therapeutics خلال مؤتمر ASCO 2025 كانت مشجعة من حيث معدلات الاستجابة وسلامة الاستخدام، ما يعزز من فرص العقار في أن يشكل خياراً علاجياً فاعلًا في المستقبل.
تصميم الدراسة السريرية
تُجرى الدراسة تحت اسم VS‑7375‑101 وتهدف إلى تقييم سلامة وفعالية العقار لدى بالغين يعانون من أورام متقدمة تحمل طفرة KRAS G12D بما في ذلك أورام البنكرياس، وقد بدأت التجربة بجرعة أولية مقدارها 400 ملليجرام يومياً وهي الجرعة نفسها التي أظهرت فعالية في دراسات سابقة أجرتها GenFleet في الصين.
وبعد الانتهاء من مرحلة تصعيد الجرعة سيتم اختيار الجرعة الأنسب لبدء المرحلة الثانية من الدراسة والتي ستركّز على توسيع الفئات المستهدفة وتقييم VS‑7375 بمفرده أو بالتزامن مع عقار Cetuximab في حالات أورام أخرى مثل القولون والمستقيم.
 التهاب البنكرياس
التهاب البنكرياس
KRAS G12D: هدف علاجي دقيق
تمثل طفرة KRAS G12D نحو 26% من مجمل الطفرات في جين KRAS، ما يجعلها الهدف الأكثر شيوعاً بين الطفرات ذات الصلة بأورام البنكرياس، وتُقدّر نسبة انتشارها في هذا النوع بنحو 37%، كما تظهر بنسب متفاوتة في القولون وبطانة الرحم والرئة.
ورغم هذا الانتشار لا يزال السوق الطبي يفتقر إلى علاجات معتمدة من FDA تستهدف هذه الطفرة بشكل مباشر وهو ما يجعل من VS‑7375 أحد أبرز المرشحين لسد هذا الفراغ العلاجي.
تحالف دولي لتطوير العلاج
تم تطوير VS‑7375 بالتعاون بين Verastem وGenFleet Therapeutics ضمن شراكة بحثية تهدف إلى استكشاف علاجات جديدة موجهة ضد الطفرات المعقدة في مسار RAS/MAPK.
وقد حصل العقار على تصريح IND في الولايات المتحدة في أبريل 2025، وانطلقت التجارب السريرية في يونيو من العام نفسه، بينما بدأ استخدامه في الصين تحت اسم GFH375 في يوليو 2024.