سهل الاستخدام.. دواء جديد لمرضى نقص المناعة الأولي
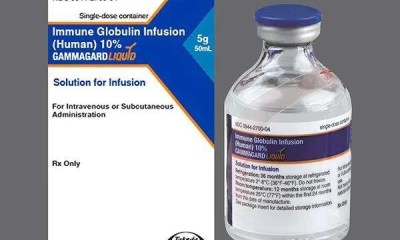
أعلنت شركة Takeda اليابانية أن إدارة الغذاء والدواء الأمريكية (FDA) وافقت على استخدام Gammagard Liquid ERC "محلول الغلوبولين المناعي البشري" لعلاج المرضى من عمر سنتين فما فوق المصابين بنقص المناعة الأولي (Primary Immunodeficiency - PI).
ويتميز الدواء الجديد بأنه أول تركيبة سائلة جاهزة للاستخدام تحتوي على مستويات منخفضة من الغلوبولين المناعي A (IgA) لا تتجاوز 2 ميكروغرام/مل في محلول بتركيز 10% ويمكن إعطاؤه عبر الوريد أو تحت الجلد.
تقليل العبء العلاجي على المرضى ومقدمي الرعاية
أوضحت الشركة أن هذا التطور يوفر خياراً علاجياً أكثر سهولة إذ أن الدواء يأتي جاهزاً للاستخدام دون الحاجة إلى إعادة التحضير ما يخفف من الأعباء اللوجستية المرتبطة بالإدارة الدوائية اليومية، كما يتيح للمرضى تلقي العلاج في عيادات الرعاية أو حتى في المنزل تحت إشراف طبي.
 تقليل العبء العلاجي على المرضى ومقدمي الرعاية
تقليل العبء العلاجي على المرضى ومقدمي الرعاية
قالت كريستينا أليكميتس، نائب الرئيس التنفيذي ورئيسة قسم البحث والتطوير في وحدة علاجات البلازما بـTakeda: "يمثل Gammagard Liquid ERC نقلة مهمة في توفير علاج مخصص وفعال لمرضى نقص المناعة الأولي خاصة لأولئك الذين لديهم حساسية تجاه مستويات IgA المرتفعة، ويُعد هذا المنتج امتداداً لتقنيات التصنيع الحديثة لدينا التي تضمن توفراً موثوقاً للعلاج وتنوعاً في الخيارات لمختلف احتياجات المرضى".
مزايا تركيبة Gammagard Liquid ERC
تستند تركيبة Gammagard Liquid ERC إلى نفس أسلوب التصنيع المتبع في Gammagard Liquid التقليدي مع تعديل في مرحلة محددة لتحسين إزالة IgA، وعلى الرغم من أن الدواء ليس مخصصاً رسمياً للمرضى الذين لديهم حساسية لـIgA فقد يكون مناسباً لبعض الحالات حسب تقدير الطبيب المعالج.
ويُشار إلى أن الدواء محظور استخدامه لدى من لديهم تاريخ من فرط التحسس الشديد تجاه المنتج أو من أظهروا أعراضاً تحسسية في السابق تجاه مكونات الغلوبولين المناعي.
التحذيرات والمخاطر المصاحبة للعلاج
تحذر النشرة الطبية الخاصة بالدواء من عدد من التفاعلات الجانبية المحتملة، من بينها:
 التحذيرات والمخاطر المصاحبة للعلاج
التحذيرات والمخاطر المصاحبة للعلاج
ردود الفعل التحسسية الشديدة بما في ذلك الحساسية المفرطة (Anaphylaxis) حتى لدى من سبق لهم تحمل العلاجات المشابهة.
اختلال وظائف الكلى خاصة لدى المرضى المعرضين للفشل الكلوي.
خطر حدوث الجلطات ما يستدعي مراقبة دقيقة وترطيب كافٍ قبل بدء التسريب الوريدي.
متلازمة التهاب السحايا العقيم (Aseptic Meningitis Syndrome) وقد تزول الأعراض خلال أيام بعد وقف العلاج.
التحلل الدموي خاصة لدى المرضى الذين يحملون أجساماً مضادة لمكونات الدم.
إصابات رئوية غير مرتبطة بالقلب قد تحدث مع العلاج الوريدي (TRALI).
احتمالية انتقال فيروسات أو مسببات عدوى عبر البلازما البشرية رغم عدم تسجيل أي حالة مؤكدة لعدوى فيروسية أو مرض كروتزفيلد-جاكوب حتى الآن.
تأثيرات على نتائج التحاليل المخبرية قد تؤدي إلى نتائج إيجابية كاذبة في بعض الاختبارات السيرولوجية.
معلومات عن مرض نقص المناعة الأولي
نقص المناعة الأولي هو مجموعة من أكثر من 550 اضطراباً نادراً ومزمناً ناتجة عن خلل في الجهاز المناعي وعادةً ما يكون السبب وراثياً، وتتفاوت الأعراض بين المرضى لكنها تشمل غالباً التهابات متكررة أو مستمرة ومظاهر مناعية ذاتية غير معتادة، وتشير التقديرات إلى أن حالة واحدة من كل 1,200 شخص في الولايات المتحدة تعاني من أحد أشكال نقص المناعة الأولي.
 معلومات عن مرض نقص المناعة الأولي
معلومات عن مرض نقص المناعة الأولي
إطلاق مرتقب في الولايات المتحدة وأوروبا
من المتوقع أن يتم تسويق Gammagard Liquid ERC في الولايات المتحدة خلال عام 2026 على أن يتبعه طرح الدواء في أوروبا عام 2027 تحت الاسم التجاري DEQSIGA وذلك بعد موافقة وكالة الأدوية الأوروبية (EMA).
وفي الوقت ذاته، أعلنت الشركة نيتها التوقف عن إنتاج Gammagard S/D وهو النسخة المجففة بالتجميد (lyophilized) من العلاج التي تحتوي على أقل من 1 ميكروغرام/مل من IgA بتركيز 5%، وقد برّرت Takeda هذا القرار بأن أسلوب التصنيع القديم لم يعد قادراً على تلبية الطلب المستقبلي بشكل مستدام ومن المنتظر إيقاف التصنيع نهائياً بنهاية ديسمبر 2027 مع الاستمرار في توفير المخزون المتبقي حتى نفاده أو انتهاء صلاحيته.




