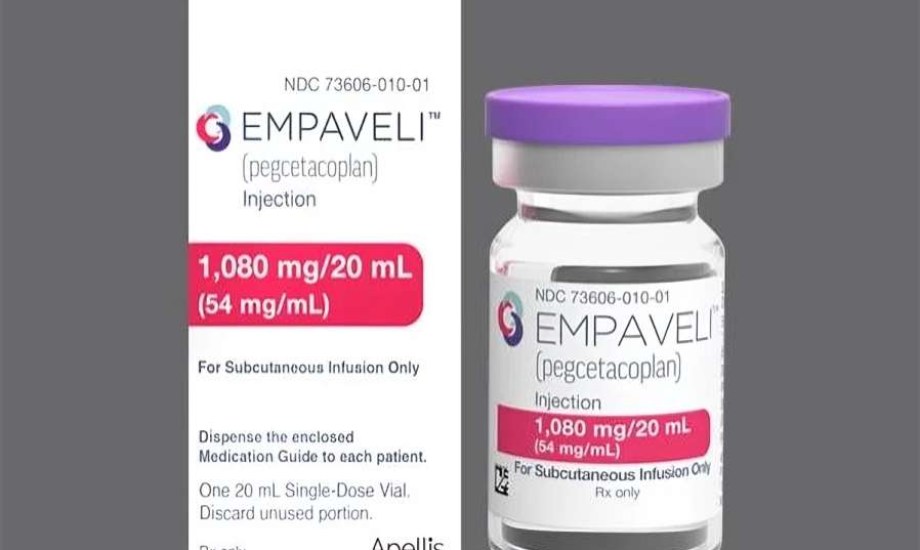
أمل جديد لمرضى الكلى.. أول دواء يقلل الحاجة للغسيل الكلوي
في إنجاز طبي جديد يفتح باب الأمل لمرضى اضطرابات الكلى النادرة، أعلنت إدارة الغذاء والدواء الأمريكية (FDA) موافقتها على استخدام Empaveli (وهو الاسم التجاري للمادة الفعالة pegcetacoplan) كأول علاج معتمد لحالات التهاب كبيبات الكلى المرتبط بالمكون C3 (C3G)، والتهاب كبيبات الكلى الأولي المعقد بالمناعة ذو النمط التكاثري الغشائي (IC-MPGN).
أول علاج دوائي لمرضى نادرين
تشمل الموافقة المرضى من عمر 12 عاماً فما فوق، ويستهدف الدواء تقليل البروتين في البول (proteinuria)، وهي إحدى العلامات السريرية المرتبطة بتلف وحدات التصفية في الكلى لدى المصابين بهذه الأمراض.
ويُعد هذا الاعتماد أول تدخل دوائي موجه لهذه الفئات من المرضى الذين غالباً ما يعانون من تطور سريع نحو الفشل الكلوي، ما يستلزم اللجوء إلى الغسيل الكلوي أو زراعة الكلى مدى الحياة.
 أول علاج دوائي لمرضى نادرين
أول علاج دوائي لمرضى نادرين
نتائج واعدة من دراسة VALIANT
استندت موافقة FDA إلى نتائج المرحلة الثالثة من الدراسة السريرية VALIANT التي أظهرت أن المرضى الذين تلقوا "Empaveli" سجلوا انخفاضاً بنسبة 68% في نسبة البروتين في البول مقارنة بمن تلقوا علاجاً وهمياً، كما أظهرت الدراسة استقراراً في وظائف الكلى وتراجعاً ملحوظاً في ترسيب مركبات C3 داخل أنسجة الكلى وهو أحد المؤشرات الحيوية لحدة المرض.
وأشارت نتائج الدراسة إلى أن 71% من المرضى الذين تلقوا الدواء حققوا صفراً في شدة ترسيب C3 وفقاً لنتائج الفحص المناعي، ما يُشير إلى إزالة شبه كاملة للترسبات، وقد تكررت هذه النتائج الإيجابية لدى كل من المرضى البالغين والمراهقين وكذلك في حالات C3G التي ظهرت مجدداً بعد زراعة الكلى.
تصريحات الباحثين
وصفت الدكتورة كارلا نيستر، الباحثة الرئيسية في الدراسة وأستاذة طب الأطفال في جامعة أيوا، الموافقة بأنها لحظة فارقة في علاج أمراض الكلى النادرة، مضيفة: "مع غياب العلاجات الفعالة غالباً ما يتدهور هؤلاء المرضى نحو فشل كلوي كامل لذا فإن هذه الموافقة تُعد تطوراً بالغ الأهمية خاصةً للأطفال".
الآثار الجانبية
رغم فعاليته اللافتة رُصدت بعض الآثار الجانبية الشائعة مع Empaveli، من بينها:
 الآثار الجانبية الشائعة لدواء Empaveli
الآثار الجانبية الشائعة لدواء Empaveli
تفاعلات في موضع الحقن
الحمى
التهاب الأنف والبلعوم
أعراض الإنفلونزا
السعال
ويُنصح بمراقبة المرضى عند بدء العلاج خاصة فيما يتعلق بالتفاعل في موضع الحقن والأعراض التنفسية.