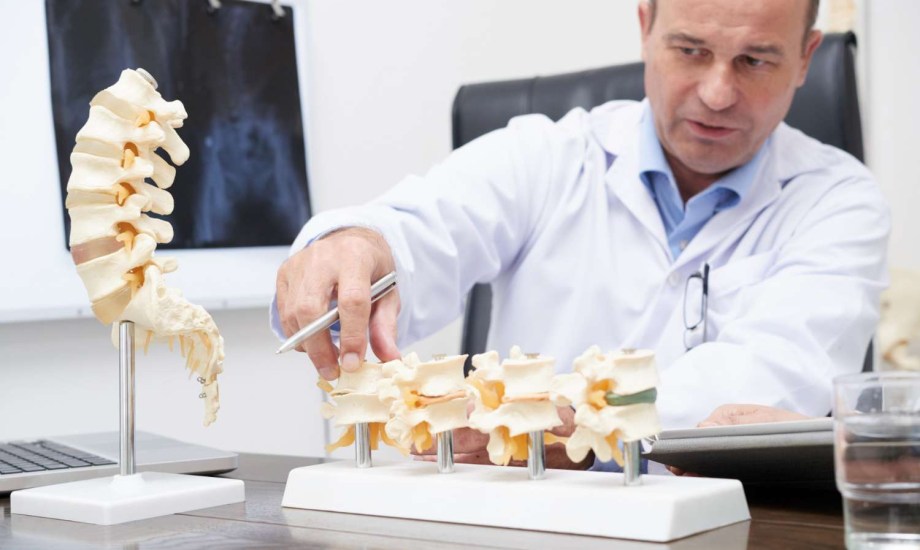
دواء "Bomyntra" لعلاج مضاعفات الأورام والعظام.. دواعي وموانع الاستخدام
أعلنت شركة Fresenius Kabi عن حصولها على موافقة إدارة الغذاء والدواء الأمريكية (FDA) على استخدام دواء "Bomyntra denosumab-bnht" كبديل حيوي للدواء المرجعي "Xgeva denosumab"، وتشمل الموافقة جميع المؤشرات العلاجية للعقار المرجعي ما يوسّع خيارات العلاج المتاحة للمرضى الذين يعانون من مضاعفات سرطانية في العظام. شركة Fresenius Kabi للأدوية
شركة Fresenius Kabi للأدوية
مؤشرات استخدام Bomyntra
يُستخدم "Bomyntra denosumab-bnht" في عدد من الحالات المرتبطة بمضاعفات الأورام والعظام، من بينها:
الوقاية من الأحداث المرتبطة بـ الهيكل العظمي لدى البالغين المصابين بـ"multiple myeloma".
علاج النقائل العظمية الناتجة عن الأورام الصلبة.
علاج "hypercalcemia of malignancy" في الحالات التي لا تستجيب للعلاج بـ"bisphosphonate".
علاج "giant cell tumor of bone" لدى البالغين والمراهقين الذين بلغوا مرحلة النضج العظمي.
موانع الاستخدام والتحذيرات
يحظر استخدام "Bomyntra" في المرضى الذين يعانون من "hypocalcemia" (نقص الكالسيوم في الدم)، كما لا يُنصح به في حال وجود حساسية معروفة تجاه أي من مكونات منتجات "denosumab"، وتوصي الشركة المنتجة بمراجعة معلومات السلامة الكاملة والإرشادات الخاصة بوصف الدواء قبل الاستخدام.
دراسات داعمة للموافقة
استندت موافقة FDA على بيانات تحليلية متقدمة ودراسات سريرية مثل "pharmacokinetic" و"pharmacodynamic" شملت متطوعين أصحاء لتقييم امتصاص الدواء واستجابة الجسم له، ودراسة سريرية لتقييم الفاعلية والسلامة والاستجابة المناعية لدى نساء مصابات بـ هشاشة العظام بعد انقطاع الطمث، ما يعكس اتساع قاعدة البيانات التي دعمت سلامة وفاعلية الدواء كبديل حيوي.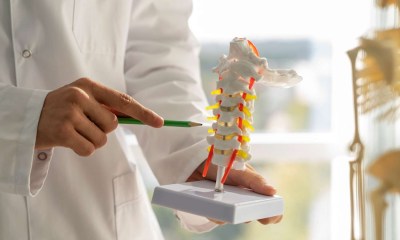 علاج هشاشة العظام للنساء بعد إنقطاع الطمث
علاج هشاشة العظام للنساء بعد إنقطاع الطمث
"Fresenius Kabi" ودورها في تطوير البدائل الحيوية
تُعد Fresenius Kabi من الشركات الرائدة في قطاع الرعاية الصحية العالمي وتُعرف بالتزامها بتوفير أدوية عالية الجودة بأسعار معقولة، وتشمل محفظتها منتجات الوريد والتغذية السريرية والتقنيات الطبية والبدائل الحيوية المبتكرة في مجالات مثل أمراض المناعة الذاتية والأورام.